Härtebildner im Wasser
Härtebildner sind gelöste Ionen von Erdalkalimetallen, die maßgeblich die Wasserhärte bestimmen. Hauptsächlich sind dies Calcium- und Magnesiumionen, wobei auch Strontium und Barium in geringen Mengen vorkommen können. Diese Ionen können schwerlösliche Verbindungen wie Kalk (Calciumcarbonat) und Kalkseifen bilden.
In Regionen mit kalkhaltigem Gestein, durch das Wasser fließt, wird eine höhere Menge dieser Härtebildner gelöst, was zur Bildung von hartem Wasser führt. In Gebieten mit granit- oder schieferhaltigem Boden ist das Wasser hingegen tendenziell weicher. Die Härte des Wassers kann jedoch auch durch die Menge an gelöstem Kohlendioxid beeinflusst werden, das die Löslichkeit von Calcium und Magnesium erhöht.
Weiches Wasser hinterlässt keine Kalkrückstände auf Pflanzen und Gartenwerkzeugen, vermeidet die Verkalkung von Haushaltsgeräten und reduziert den Waschmittelverbrauch. Hartes Wasser enthält dagegen nützliche Mineralien wie Calcium und Magnesium, die für den menschlichen Körper vorteilhaft sind.
Die Rolle von Calcium und Magnesium
Calcium und Magnesium spielen eine wichtige Rolle im menschlichen Körper. Der menschliche Organismus enthält etwa 1000 bis 1500 Gramm Calcium, das überwiegend in Knochen und Zähnen eingelagert ist, und dieses Mineral ist essentiell für die Knochenfestigkeit, die Zahngesundheit sowie die Muskel- und Nervenfunktion. Es trägt zur Blutgerinnung bei und reguliert die Aktivität zahlreicher Enzyme sowie die Ausschüttung von Hormonen.
Magnesium wird in geringeren Mengen im Körper gespeichert (etwa 470 mg/kg) und ist besonders wichtig für den Energiestoffwechsel und die Enzymfunktion. Es stabilisiert den Herzrhythmus und unterstützt die Gesundheit von Muskeln und Nerven. Im Blutplasma spielt Magnesium eine zentrale Rolle bei biochemischen Reaktionen.
Der tägliche Bedarf an diesen Mineralien wird hauptsächlich durch die Nahrung gedeckt, und Trinkwasser trägt nur einen kleinen Teil zur täglichen Zufuhr bei. Milchprodukte, Fleisch und verschiedene Gemüsearten sind reich an Calcium, während Magnesium in vielen Vollkornprodukten, Nüssen und grünem Blattgemüse zu finden ist.
Achten Sie bei der Auswahl Ihrer Lebensmittel auf eine ausreichende Nährstoffdichte, um die Gesundheit von Knochen, Zähnen und Muskeln optimal zu unterstützen. Wasseraufbereitungsverfahren wie der Ionenaustausch, bei dem Calcium und Magnesium durch Natrium ersetzt werden, spielen für die gesundheitliche Versorgung nur eine untergeordnete Rolle.
Verschiedene Härtearten
Die Wasserhärte wird in Gesamthärte, Carbonathärte und Nichtcarbonathärte unterteilt.
- Gesamthärte: Sie gibt die Konzentration aller Erdalkalimetallionen im Wasser an, hauptsächlich Calcium- und Magnesiumionen. Diese wird in Millimol pro Liter (mmol/l) gemessen.
- Carbonathärte: Diese, auch temporäre Härte genannt, bezieht sich auf den Anteil der Erdalkalimetalle, der als Hydrogencarbonate (HCO₃⁻) vorliegt. Sie kann durch Erhitzen des Wassers reduziert werden.
- Nichtcarbonathärte: Diese permanente Härte bezieht sich auf Calcium- und Magnesiumionen, die an Anionen wie Chloride, Nitrate und Sulfate gebunden sind und nicht durch Erhitzen entfernt werden können.
Diese Härtekategorien helfen, die Eignung des Wassers für unterschiedliche Anwendungen zu bestimmen und werden oft in weich (weniger als 8,4 °dH), mittelhart (8,4 bis 14 °dH) und hart (mehr als 14 °dH) unterteilt.
Auswirkungen der Wasserhärte
Die Wasserhärte beeinflusst viele Aspekte des Haushalts, der Körperpflege und der Funktionalität von Geräten.
- Kalkablagerungen: Diese entstehen in Haushaltsgeräten und Rohrleitungen und können deren Lebensdauer verkürzen.
- Erhöhter Reinigungsmittelverbrauch: Härtebildner wie Calcium und Magnesium reagieren mit Seifen und mindern deren Reinigungswirkung.
- Haut- und Haarpflege: Hartes Wasser kann Haut und Haare austrocknen und bei Hauterkrankungen wie Neurodermitis verstärkende Symptome verursachen.
- Geschmack und Aussehen von Lebensmitteln: Wasserhärte kann den Geschmack und das Aussehen von Getränken und Speisen beeinflussen.
Weiches Wasser reduziert den Verbrauch von Wasch- und Reinigungsmitteln, führt zu geringeren Kalkablagerungen und verbessert die Effizienz von Haushaltsgeräten. Für die Haut- und Haarpflege ist weiches Wasser ebenfalls vorteilhafter.
Bestimmung der Wasserhärte
Die Bestimmung der Wasserhärte kann chemisch oder physikalisch erfolgen. Eine gebräuchliche Methode ist die komplexometrische Titration mit EDTA (Ethylendiamintetraessigsäure). Bei dieser Methode wird eine Wasserprobe mit einem pH-Puffer und einem Indikator versetzt und dann mit einer EDTA-Lösung titriert, bis eine Farbänderung eintritt. Die EDTA-Lösung bindet Calcium- und Magnesiumionen, und die verbrauchte Menge gibt Aufschluss über die Wasserhärte.
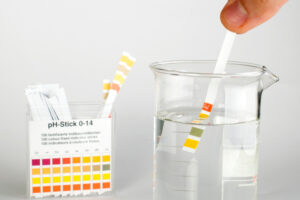
Für den Hausgebrauch sind Teststreifen praktisch. Diese werden ins Wasser getaucht und färben sich je nach Härtegrad. Eine Vergleichsskala zeigt den Härtegrad an.
Professionelle Wasseranalysen durch Labore bieten exakte Ergebnisse und können spezielle Anforderungen erfüllen, zum Beispiel durch Ionenchromatografie oder Kapillarelektrophorese.
Tipps zur Durchführung der Wasserhärtebestimmung
- Besorgen Sie sich rechtzeitig alle benötigten Materialien, wie Indikatoren, Pufferlösungen und Teststreifen.
- Achten Sie auf saubere und genaue Arbeitstechniken, um verlässliche Ergebnisse zu erhalten.
- Überprüfen Sie regelmäßig die Wasserhärte, besonders im Garten, um Maßnahmen zur Enthärtung oder Anpassung der Bewässerung vorzunehmen.
Einheiten der Wasserhärte
Die Wasserhärte wird meist in Millimol pro Liter (mmol/l) und Grad deutscher Härte (°dH) gemessen. Auch Grad französischer Härte (°fH) findet Anwendung.
- Millimol pro Liter (mmol/l): Beschreibt die Konzentration der Härtebildner im Wasser.
- Grad deutscher Härte (°dH): Eine traditionelle Einheit, bei der 1 °dH gleichbedeutend ist mit 10 mg Calciumoxid pro Liter Wasser.
- Grad französischer Härte (°fH): Entspricht 10 mg Calciumcarbonat pro Liter Wasser.
Für die Dosierung von Wasch- und Reinigungsmitteln ist es wichtig, die Wasserhärte in der am Standort üblichen Einheit zu kennen. Fragen Sie bei Ihrem Wasserversorger nach den Werten in Ihrer Region.
Entstehung der Wasserhärte
Die Wasserhärte entsteht durch das Lösen von Mineralien wie Calcium- und Magnesiumverbindungen, wenn Wasser durch unterschiedliche geologische Schichten fließt. Je mehr Kohlendioxid im Wasser vorhanden ist, desto höher wird die Löslichkeit dieser Mineralien. Kohlensäure, gebildet durch die Reaktion von Wasser mit Kohlendioxid, löst Calcium- und Magnesiumionen aus kalkhaltigen Böden. In Regionen mit Granit, Gneis oder Basalt bleibt das Wasser weicher, da diese Gesteine weniger lösliche Mineralien enthalten.
Weitere Faktoren, die die Härtebildung beeinflussen, sind die Tätigkeit von Mikroorganismen im Boden und menschliche Aktivitäten wie landwirtschaftliche Nutzung.
Entfernung der Wasserhärte (Wasserenthärtung)
Die Reduktion der Wasserhärte kann durch verschiedene Verfahren erreicht werden:
- Ionenaustauschverfahren: Calcium- und Magnesiumionen werden durch Natriumionen ersetzt. Dies ist eine gängige Methode für Haushaltswasserenthärter. Das Ionenaustauscherharz muss nach Erschöpfung regeneriert werden.
- Entkarbonisierung: Hierbei wird die Carbonathärte durch Zugabe von Calciumhydroxid verringert.
- Vollentsalzung: Diese Technik entfernt alle Ionen aus dem Wasser, nötig für Anwendungen, die sehr reines Wasser erfordern.
- Komplexbildung: Polyphosphate bilden mit Calcium- und Magnesiumionen wasserlösliche Komplexe, die die Härte verringern.
Neben diesen chemischen Methoden gibt es physikalische Verfahren zur Enthärtung, deren Wirksamkeit jedoch umstritten ist.
Für naturnahe Gärtner kann es hilfreich sein, hartes Wasser zu enthärten, um Kalkablagerungen auf Pflanzen und Gartengeräten zu vermeiden. Der Ionenaustausch ist oft die einfachste Methode für den Haushaltsgebrauch.
Härtebereiche für Waschmittel
Seit 2007 sind die Härtebereiche für Waschmittel gemäß dem Wasch- und Reinigungsmittelgesetz (WRMG) europäisch standardisiert:
- Weich: weniger als 1,5 Millimol Calciumcarbonat je Liter (unter 8,4 °dH).
- Mittel: 1,5 bis 2,5 Millimol Calciumcarbonat je Liter (8,4 bis 14 °dH).
- Hart: mehr als 2,5 Millimol Calciumcarbonat je Liter (über 14 °dH).
Die Dosierempfehlungen für die jeweiligen Härtebereiche finden Sie auf der Rückseite der Waschmittelverpackung. Beachten Sie diese Anweisungen, um die beste Wascheffizienz zu erzielen und die Umwelt zu schonen.
Wasserhärte und Gesundheit
Hartes Wasser ist gesundheitlich unbedenklich. Die enthaltenen Mineralien Calcium und Magnesium sind vorteilhaft für Ihre Gesundheit, da sie wesentliche Bestandteile des menschlichen Körpers sind. In Gebieten mit hoher Wasserhärte wurden sogar tendenziell weniger Herzerkrankungen registriert, was auf eine höhere Mineralstoffaufnahme durch hartes Wasser hinweist.
Allerdings kann die Enthärtung von Wasser durch Ionenaustausch zu einem höheren Natriumgehalt führen, was bei Menschen mit hohem Natriumkonsum problematisch sein kann. Dennoch spielt Trinkwasser meist nur eine geringe Rolle in der täglichen Natriumaufnahme, und eine ausgewogene Ernährung kann dies ausgleichen.
Für eine optimale Versorgung mit diesen Mineralstoffen sollten Sie auf eine gesunde Ernährung achten.
Einfluss der Geologie
Die geologischen Verhältnisse einer Region bestimmen maßgeblich die Härte des Wassers. Regenwasser, das auf die Erde gelangt, nimmt bei seiner Versickerung durch verschiedene Gesteinsschichten Mineralien auf, insbesondere Calcium und Magnesium.
- Kalkhaltige Gesteine: Wasser, das durch Kalk- und Sandstein fließt, nimmt Calcium und Magnesium auf und wird dadurch härter.
- Granit, Gneis und Basalt: Diese Gesteine enthalten weniger lösliche Mineralien, sodass das Wasser weicher bleibt.
- Mikroorganismen und menschliche Einflüsse: Organische Aktivität und landwirtschaftliche Nutzung können die Mineralienkonzentration im Wasser beeinflussen.
Die Wasserhärte variiert daher stark je nach geologischer Beschaffenheit der Region. Indem Sie die geologischen Eigenschaften Ihrer Region kennen, können Sie besser nachvollziehen, warum Ihr Wasser einen bestimmten Härtegrad aufweist und entsprechend reagieren.