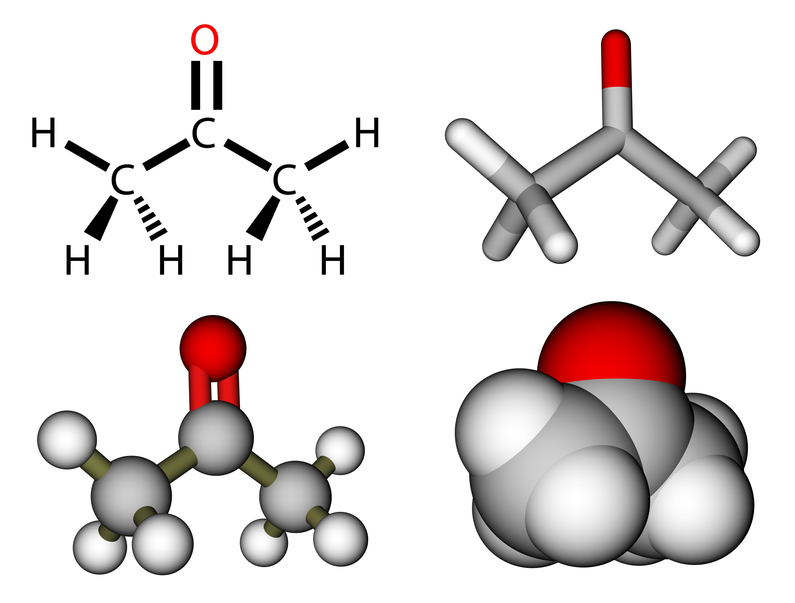
Was ist Aceton?
Aceton, auch bekannt als Propanon oder Dimethylketon, ist eine farblose Flüssigkeit mit einem bemerkenswert süßlichen bis leicht fruchtigen Geruch. Chemisch gehört Aceton zur Gruppe der Ketone und ist das einfachste Keton, charakterisiert durch die Summenformel C3H6O, eine molare Masse von 58,08 g/mol und eine Dichte von 0,79 g/cm³ bei 20 °C.
Aceton ist vollständig mischbar mit Wasser und vielen organischen Lösungsmitteln, was es zu einem nützlichen Stoff in verschiedenen Bereichen macht. Haushalte verwenden Aceton vor allem als Nagellackentferner, während die Industrie es als Lösungsmittel und als Zwischenprodukt in chemischen Synthesen, etwa bei der Herstellung von Polymethylmethacrylat (PMMA) für Acrylglas, nutzt.
Mit einem Siedepunkt von 56 °C ist Aceton leicht entflammbar und verdampft schnell. Es ist ein polares aprotisches Lösungsmittel, das viele Substanzen ohne Ausbildung eigener Polymere effektiv lösen kann, was es in der chemischen Industrie besonders wertvoll macht.
Physikalische und chemische Eigenschaften von Aceton
Aceton hat viele bemerkenswerte physikalische und chemische Eigenschaften, die es zu einem vielseitigen Lösungsmittel machen.
Physikalische Eigenschaften:
- Dichte: Bei 20 °C hat Aceton eine Dichte von 0,79 g/cm³.
- Schmelzpunkt: Der Schmelzpunkt liegt bei -95 °C.
- Brechungsindex: Der Brechungsindex beträgt 1,3588 (bei 20 °C).
- Dampfdruck: Der Dampfdruck beträgt bei 20 °C 246 hPa.
- Flammpunkt: Mit einem Flammpunkt von -20 °C ist Aceton hochentzündlich.
- Wasserlöslichkeit: Aceton ist unbegrenzt in Wasser löslich, da es Wasserstoffbrückenbindungen mit Wassermolekülen eingeht.
Chemische Eigenschaften:
- Polarität: Als polares Lösungsmittel löst Aceton polare Substanzen wie Wasser, Methanol und Chloroform.
- Keto-Enol-Tautomerie: Aceton kann zwischen Keto- und Enolform wechseln, was für bestimmte chemische Reaktionen wichtig ist.
- CH-Acidität: Die Methylgruppen in Aceton weisen eine signifikante CH-Acidität auf, was bedeutet, dass Aceton durch starke Basen deprotoniert werden kann, um ein resonanzstabilisiertes Carbanion zu bilden.
Wo kommt Aceton vor?
Aceton kommt sowohl natürlich als auch synthetisch vor.
In der Natur:
- Pflanzen: Es kommt in geringen Mengen in Pflanzen und Früchten wie Himbeeren und Tomaten vor.
- Menschlicher Körper: Es wird im menschlichen Körper bei der Fettverbrennung in der Leber produziert und über Urin oder Atemluft ausgeschieden, was bei bestimmten Erkrankungen wie Diabetes zu einem typischen Geruch führen kann.
- Andere Quellen: Durch den fermentativen Abbau organischer Materialien kann ebenfalls Aceton entstehen.
Industrielle Herstellung:
Die großtechnische Produktion von Aceton erfolgt hauptsächlich über das Cumolhydroperoxid-Verfahren. Weitere Verfahren beinhalten die Dehydrierung von Isopropanol und die trockene Holzdestillation.
Wofür wird Aceton verwendet?
Aceton hat eine breite Palette von Anwendungen, sowohl im Haushalt als auch in der Industrie:
- Lösungs- und Reinigungsmittel: Sie können Aceton nutzen, um Harze, Fette, Öle und Cellulose zu lösen. Es eignet sich hervorragend zum Entfernen von wasserfesten Stiften und Insektenresten sowie zum Entfetten von Oberflächen vor dem Lackieren.
- Synthesestoff: In der chemischen Industrie dient Aceton als Ausgangsstoff für die Herstellung von Diacetonalkohol, Chloroform und PMMA, das als Acrylglas bekannt ist.
- Kraftstoff-Zusatz: In einigen Ländern wird Aceton in kleinen Anteilen Benzin oder Diesel beigefügt, um die Verbrennung zu verbessern.
- Klebstoffzusatz: Aceton wird in verschiedenen Klebstoffen verwendet und eignet sich zum Lösen harter Klebstoffe wie Sekundenkleber.
- Abbeizmittel: Sie können es effektiv zum Abbeizen von Lacken und Farben einsetzen.
- Zahnmedizin: Zahnärzte verwenden Aceton zur Reinigung von Wurzelkanälen und präparierten Dentinflächen, um eine optimale Haftung von Füllmaterialien zu gewährleisten.
- Elektrotechnik: In der Elektronikindustrie wird Aceton zur Entfettung von Leiterplatten und anderen elektronischen Bauteilen vor dem Löten verwendet.
Ist Aceton gefährlich?
Der Umgang mit Aceton birgt verschiedene Risiken. Aceton ist hochentzündlich und kann in Kombination mit Luft explosive Gemische bilden. Es sollte daher fern von Wärmequellen, offenen Flammen und Funken aufbewahrt werden.
Bei direktem Hautkontakt kann Aceton zu trockener Haut und Ekzemen führen, indem es die natürlichen Fette der Haut entfernt. Es kann auch das Keratin in Nägeln schädigen und diese brüchig machen. Das Einatmen von Acetondämpfen kann Kopfschmerzen, Schwindel und Müdigkeit verursachen, und langfristige Exposition kann zu ernsteren Atemproblemen führen.
Schützen Sie sich beim Umgang mit Aceton durch ausreichende Belüftung, das Tragen von Schutzhandschuhen und gegebenenfalls Atemschutzmasken. Der direkte Hautkontakt sollte vermieden und eine sichere Lagerung beachtet werden.
Aceton im menschlichen Körper
Im menschlichen Körper entsteht Aceton als Ketonkörper bei der Fettverbrennung in der Leber. Anders als andere Ketonkörper kann Aceton nicht weiter verstoffwechselt werden und wird über die Atemluft oder den Urin ausgeschieden.
Unter normalen Bedingungen ist der Acetonspiegel im Körper gering. Bei Stoffwechselstörungen, wie Insulinmangel bei Diabetes mellitus, kann der Acetonspiegel jedoch erhöht sein, was zu einer sogenannten Ketoazidose führen kann, einer lebensbedrohlichen Stoffwechselentgleisung.
Erhöhte Acetonwerte können auftreten bei:
- Diabetes mellitus: Insbesondere bei Insulinmangel, wenn der Körper von der Glukose- zur Fettverbrennung übergeht.
- Fasten oder Hunger: Längerer Nahrungsentzug führt dazu, dass der Körper auf Fettreserven zur Energiegewinnung zurückgreift.
Symptome erhöhter Acetonwerte:
- Fruchtig riechender Atem, oft als Geruch nach süßem Obst oder Nagellackentferner beschrieben.
- Übelkeit, Erbrechen und Bauchschmerzen aufgrund der metabolischen Ketoazidose.
- In schweren Fällen Atemnot und Bewusstlosigkeit durch die Übersäuerung des Blutes.
Das frühzeitige Erkennen dieser Symptome und eine rasche medizinische Intervention sind entscheidend, um ernsthafte gesundheitliche Konsequenzen zu vermeiden.